【国内法规072】广州市卫生健康委员会关于部分消毒剂在新型冠状病毒感染的肺炎疫情防控期间紧急上市的通知
各区卫生健康局、市卫生监督所,广州市各消毒产品责任单位:
在新型冠状病毒感染的肺炎疫情防控期间,为确保紧急上市消毒产品的安全性和有效性,保障广大人民群众生命安全和身体健康,根据《广东省卫生健康委办公室转发国家卫生健康委办公厅关于部分消毒剂在新型冠状病毒感染的肺炎疫情防控期间紧急上市的通知》(粤卫办监督函〔2020〕6号)文件精神,对符合要求的部分消毒剂上市销售使用前,进行紧急上市备案。现就有关事项通知如下:
一、紧急上市备案对象
在广州市辖区范围内的消毒产品责任单位(国产消毒产品责任单位为生产企业,委托生产加工时特指委托方;进口消毒产品的责任单位为在华责任单位)生产或经营的乙醇类消毒剂、含氯消毒剂(次氯酸钠、次氯酸钙、二氯异氰尿酸钠、三氯异氰尿酸)、二氧化氯消毒剂及过氧乙酸消毒剂。
二、备案要求
(一)国产产品生产企业已取得《消毒产品生产企业卫生许可证》并在有效期限内,且拟生产消毒产品符合许可证生产项目、生产类别、生产目录和生产工艺要求,若不一致,请先变更卫生许可证;与已备案产品同类的进口产品,可提供生产国(地区)上市证明文件。
(二)已备案上市的消毒剂,产品责任单位因扩大其生产规模而增加生产线、生产车间或生产地点的,产品责任单位应确保生产环境、生产设备、产能符合拟生产消毒剂要求。
(三)醇类手消毒剂醇类有效成分浓度>60%(V/V),其他乙醇消毒液原料应当符合GB26373-2010《乙醇消毒剂卫生要求》且乙醇含量为70%-80%(V/V)。
(四)检验报告应当由通过计量认证的检验机构出具。
(五)提供的检验项目包括有效成分含量及pH值,同时提供按照《消毒产品卫生安全评价技术要求》(WS628-2018)要求进行的其余检测项目的检验委托单。
(六)标签说明书应符合《消毒产品标签说明书管理规范》,禁止出现宣传或暗示对疾病有预防或治疗功效的内容;已备案上市消毒剂扩大生产的,除生产企业信息外,其他信息原则上与已备案标签说明书一致。
(七)其他:提交的资料应齐全,提供的复印件应清晰、无涂改,所有材料(除检验报告外)应加盖产品责任单位公章,84消毒液有效期限定为3个月(有稳定性检测报告的除外)。
三、提交纸质材料清单
(一)《在新型冠状病毒感染的肺炎疫情防控期间紧急上市的消毒产品信息表》(原件加盖企业公章)
(二)国产产品生产企业《消毒产品生产企业卫生许可证》(复印件加盖企业公章)
(三)进口消毒剂生产国(地区)允许产品上市证明文件(复印件及翻译件加盖企业公章)
(四)产品有效成分含量及pH值检验合格报告(原件)
(五)其他检验项目检测委托单(复印件加盖企业公章)(六)标签(铭牌)、说明书(原件加盖企业公章)
(七)产品责任单位《营业执照》(复印件加盖企业公章)
(八)《紧急上市产品质量安全承诺书》(原件加盖企业公章)
四、流程指引图:
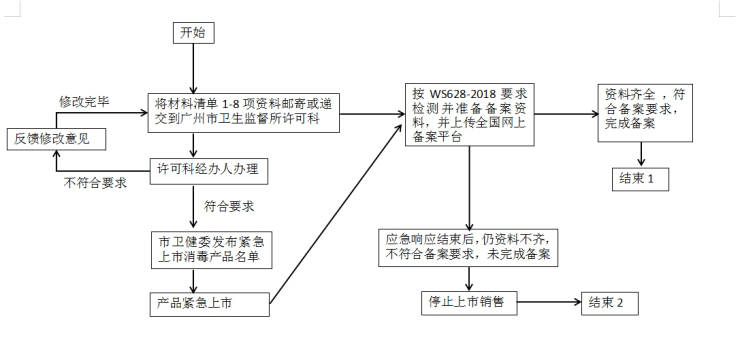
五、产品申报方式
以上资料加盖产品责任单位公章后递交或邮寄到广州市卫生监督所(联系地址:广州市越秀区中山三路23号广州市卫生监督所;联系电话:83880578;联系人:林翠屏)。
六、信息公开
完成形式审查后的消毒产品信息将定期在广州市卫生健康委员会官方网站进行信息公开。
七、产品后续备案须知
上述产品在上市销售使用的同时,产品责任单位应当按照《消毒产品卫生安全评价技术要求》(WS628-2018)的检验项目进行检测,并按规定进行备案。新型冠状病毒感染的肺炎疫情防控应急响应结束后,仍未完成消毒产品卫生安全评价备案的,应当立即停止生产销售。有继续生产销售意愿的,应当按照原有正常程序办理相关手续,否则将按照《传染病防治法》、《消毒管理办法》等有关规定严肃查处。
附件:1.在新型冠状病毒感染的肺炎疫情防控期间紧急上市的消毒产品信息表
2.紧急上市产品质量安全承诺书
广州市卫生健康委员会
2020年2月8日
请下载附件:1.在新型冠状病毒感染的肺炎疫情防控期间紧急上市的消毒产品信息表.doc
凡注明“来源:XXX”的文章,均转载自其它媒体,转载目的在于传递更多的信息,并不代表本网赞同其观点和对其真实性负责。如因文章内容、版权等其他问题,请同本网联系。





